Существенной особенностью реакций получения и превращений производных ароматических углеводородов является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направление реакций замещения в бензольном ядре, называются правилами ориентации.
Реакционная способность того или иного атома углерода в бензольном кольце определяется следующими факторами: 1) положением и природой уже имеющихся заместителей, 2) природой действующего агента, 3) условиями проведения реакции. Решающее влияние имеют два первых фактора.
Заместители в бензольном кольце можно разделить на две группы.
Электронодонорные (первого рода) - это группировки атомов, способные отдавать электроны. К ним относятся ОН, OR, RCOO, SH, SR, NH 2 , NHR, NR 2 , NHCOR, -N=N-, CH 3 , CH 2 R, CR 3 , F, CI, Br, I.
Электроноакцепторные заместители (второго рода) - это атомные группировки, способные оттягивать, принимать электроны от бензольного ядра. К ним относятся S0 3 H, N0 2 , CHO, COR, COOH, COOR, CN, СС1 3 , и т. д.
Действующие на ароматические соединения полярные реагенты можно разделить на две группы: электрофильные и нуклеофильные. Наиболее характерны для ароматических соединений процессы алкилирования, галогенирования, сульфирования и нитрования. Эти процессы идут при взаимодействии ароматических соединений с электрофильными реагентами. Известны и реакции с нуклеофильными реагентами (NaOH, NH 2 Na и т. д.), например реакции гидроксилирования, аминирования.
Заместители первого рода облегчают реакции с электрофильными реагентами, причем они ориентируют новый заместитель в орто- и пара -положения.
Заместители второго рода затрудняют реакции с электрофильными реагентами: они ориентируют новый заместитель в мета-положение. В то же время эти заместители облегчают реакции с нуклеофильными реагентами.
Рассмотрим примеры реакций с различными ориентирующим действием заместителей.
1. Заместитель первого рода; реагент электрофильный. Облегчающее реакцию действие заместителя, о-, п-ориентация:

2. Заместитель второго рода; реагент электрофильный. Затрудняющее реакцию действие заместителя; м-ориентация:

3. Заместитель первого рода; реагент нуклеофильный; м-ориентация. Затрудняющее действие заместителя. Примеры таких реакций с бесспорным механизмом неизвестны.
4. Заместитель второго рода; реагент нуклеофильный, о-, п-ориентация:

Систематические исследования влияния заместителей на ориентацию в бензольном кольце были проведены А. Голлеманом. Ф. Бейльштейн установил, что при наличии нескольких заместителей преобладающее направляющее действие оказывает тот из них, который обладает наибольшим активирующим эффектом.
Важнейшие заместители по селективности ориентирующего действия в реакциях электрофильного замещения можно расположить в следующий ряд:
NH 2 > ОН > OR > CI > I > Br > CH 3 ;
COOH > S0 3 H > N0 2 .
Описанные выше правила не носят характера законов. Речь почти всегда идет только о главном направлении реакции. Очень часто в реакции образуются все возможные продукты, однако преобладают количественно те из них, которые образуются в соответствии с правилами ориентации. Так, при нитровании толуола образуется 62% орто-, 33,5% пара- и 4,5% мета- нитротолуолов.
Небольшое изменение условий проведения реакции замещения обычно не влияет на тип ориентации, однако изменяет соотношение между орто-и пара-изомерами. Значительное изменение условий, например сильное повышение температуры, оказывает влияние и на тип ориентации, так как изменяется механизм реакции. Так, например, бромирование толуола при обычной температуре дает преимущественно пара-изомер. При 400 °С соотношение между орто-, пара-, мета-изомерами 20, 57, 23%, а при 630 °С - 18,9, 21,2 и 59,9% (радикальное бромирование).
Влияние растворителей незначительно. Катализаторы могут изменить направление процесса. Так, при бромировании хлорбензола обычно образуется всего 1 % мета-изомера. В присутствии А1С1з количество его возрастает до 13%.
Механизм ориентирующего влияния заместителей. Как известно, в молекуле бензола имеет место совершенно равномерное распределение электронной плотности. Присутствие заместителя нарушает эту равномерность. Возникает чередующаяся полярность углеродных атомов в кольце - так называемый альтернирующий эффект.
Заместитель может взаимодействовать с бензольным ядром двумя способами, могут иметь место два эффекта: индукционный (I) и сопряжения (М):

В первом случае изменение плотности в ядре связано с поляризацией σ-связи между заместителем и ядром (I). Эффект (М) связан с возникновением сопряжения между р-электронами заместителя и кольца. При этом возможны два случая: электроны могут смещаться в сторону кольца (I) или в сторону заместителя (II).
В первом случае увеличивается реакционная способность бензольного кольца по отношению к электрофильным реагентам, во втором -по отношению к нуклеофильным реагентам.
О существовании двух способов взаимодействия атомов говорит сравнение дипольных моментов производных бензола с соответствующими производными метана. Из данных табл. 14 видно, что для соединений с заместителями первого рода дипольные моменты у производных бензола меньше, чем у производных метана. При заместителях второго рода наблюдается обратная картина.
Таблица 14. Дипольные моменты производных метана и бензола, D *

Дипольный момент уменьшается, если два эффекта - индукционный и сопряжения - действуют в противоположных направлениях. Наоборот, при одинаковом направлении обоих эффектов дипольные моменты увеличиваются:

Таким образом, в зависимости от природы заместителя бензольное кольцо обогащается или обедняется электронной плотностью, т. е. становится более или менее склонным к электрофильному замещению.
Реакции электрофильного замещения в ароматическом ряду обычно либо необратимые процессы, либо проводятся в условиях, далеких от равновесия. Поэтому их направление определяется не большей устойчивостью конечных продуктов по сравнению с исходными, а необходимой для их протекания энергией активации, т. е. не термодинамическими, а кинетическими факторами *. Эти реакции идут в направлении образования более выгодного переходного состояния, о структуре которого можно судить по реальной структуре промежуточного продукта - σ-комплекса (принцип Хэммонда ). Следовательно, решающим фактором, определяющим направление электрофильного замещения, является влияние заместителя на устойчивость образующегося σ-комплекса. Вообще говоря, замещение может идти в любое положение бензольного кольца, однако с различной скоростью, определяемой различной энергией активации. Энергия активации тем меньше (а скорость реакции тем больше), чем выше устойчивость σ-комплекса, точнее, чем меньшая энергия требуется для возникновения соответствующего переходного состояния. Следовательно, качественный анализ ориентационного действия каждого заместителя сводится к анализу его влияния на устойчивость возникающего при реакции σ-комплекса. А поскольку главным фактором стабильности соединений является сопряжение, в первую очередь анализируется возможность максимального сопряжения при образовании σ-комплексов с участием различных атомов углерода бензольного кольца. Если сопряжение не позволяет решить вопрос об устойчивости σ-комплексов, то анализируется характер распределения электронной плотности с учетом того, что размещение одноименных зарядов у рядом стоящих атомов требует затраты большей энергии и, следовательно, является дестабилизирующим фактором.
Роль энергетических факторов при выборе направления замещения демонстрирует рис. 60. Реакция пойдет преимущественно в условном положении 3, так как в этом случае ниже энергия активации.
При электрофильном замещении заместители первого ряда повышают стабильность σ-комплексов, отвечающих о- и п-ориентации. Так, например, в случае галогенирования анилина стабилизируются сопряжением с участием аминогруппы только σ-комплек-сы I и II. В случае σ-комлпекса III такая стабилизация невозможна; бензольное кольцо не может принять электронную пару азота (нет сопряжения) и в соответствии с этим нельзя построить граничную структуру с положительным зарядом на атоме азота:




Граничные формулы отражают крайние состояния σ-комплекса. В действительности он существует в промежуточном «мезомерном» состоянии.
При наличии в бензольном кольце заместителя второго рода сопряжение с этим заместителем в σ-комплексе невозможно, так как эти заместители не могут отдавать электроны для компенсации положительного заряда ядра. В этом случае относительно более выгоден σ-комплекс типа II, так как при его образовании не появляются два положительных заряда на рядом стоящих атомах, что исключительно невыгодно:



Таким образом, электронные эффекты облегчают или затрудняют взаимодействие реагентов с определенными атомами в бензольном кольце, изменяя устойчивость промежуточного σ-комплекса.
При удалении заместителя, находящегося в боковой цепи, его ориентирующее влияние быстро ослабевает. Это, например, видно из опытных данных по нитрованию следующих нитропроизводных:

Ясно, что при наличии нескольких заместителей больше проявляется действие того из них, который способен вызвать большее смещение электронов и сильнее стабилизировать σ-комплекс.
При наличии в соединении двух заместителей одного типа (первого или второго рода) согласованная ориентациях наблюдается только в том случае, когда они находятся в мета -положении:



При этом, если заместители разные, число изомеров, отвечающих влиянию каждого заместителя, будет различным. По ориентирующему влиянию заместители располагаются в ряды:
NH 2 > ОН > OR > OCOR > R > Hal;
СООН > SO 3 H > N0 2 .
Примером могут служить результаты нитрования различных хлортолуолов (цифры показывают процентное содержание изомеров с данным положением заместителя):

Если в соединении имеется два заместителя различных типов (первого и второго рода), то согласованная ориентация будет при расположении их в орто- и пара-положении. Однако в этом случае ориентирует только заместитель первого рода, так как только он стабилизирует промежуточный σ-комплекс. Новый заместитель оказывается в орто - или пара - положении к заместителю второго рода, который ориентирует в мета- положение. Так, например, при нитровании м-нитротолуола (несогласованная ориентация) изомерные динитрбензолы образуются в следующих количествах:

При наличии в соединении любых двух заместителей в мета-положения появление нового заместителя между ними маловероятно по стерическим соображениям.
В рассмотренных нами случаях реагентами были ионы или сильно поляризованные молекулы. Иные соотношения наблюдаются в тех случаях, когда реагент представляет собой радикал. При атаке бензольного ядра радикалом не возникает кулоновского взаимодействия его с каким-либо определенным атомом углерода, так как радикал нейтрален. Таким образом, отсутствие ориентирующего влияния различных по природе заместителей может быть доводом в пользу признания для данной реакции радикального механизма.
С сильным увеличением температуры ориентирующее влияние заместителей постепенно утрачивается, так как скорости всех трех процессов (о-, м- и п-замещения) выравниваются.
Очень интересен, хотя еще мало изучен, вопрос о соотношении между о- и п-изомерами. Здесь следует учитывать несколько факторов:
1) в бензольном кольце о-положений два, п-положение одно;
2) в о-положении могут наблюдаться пространственные затруднения (например, при нитровании толуола образуется 58% о-изомера, при нитровании в тех же условиях трет-бутилбензола - 16% о- и 73% п-изомера;
3) индукционному влиянию особенно подвержены о-положения, так как оно сильно убывает по цепи. Следовательно, если заместитель индукционно дезактивирует бензольное кольцо, эта дезактивация проявляется более всего в о-положении. Пример - хлорирование хлорбензола;
4) эффект сопряжения по невыясненным причинам более всего проявляется в п-положении.
Из рассмотренного видно, что наибольшее влияние на направление реакций ароматических соединений оказывает эффект сопряжения. Между тем сопряжение может существовать только в случае, если группы, которые могут участвовать в сопряжении, компланарны. Если оси облаков р-электронов заместителя и р-электронов бензольного кольца не параллельны, сопряжение ослабляется и заместитель теряет свое влияние на бензольное кольцо.
Эта особенность эффекта сопряжения подтвеждена многими примерами. Ниже приведены компланарные системы

и система, выведенная из компланарности (атом хлора мало подвижен)


Корреляционный анализ. Полярное влияние на реакционный центр заместителей, находящихся в п- и м-положениях, может быть описано количественно с помощью корреляционного уравнения, предложенного Л. Гамметом:
где К - константа скорости или константа равновесия для замещенного соединения; Ко - аналогичная константа для незамещенного соединения; σ - константа, характеризующая полярное влияние заместителя; р- константа, определяющая степень чувствительности реакционного центра к полярным эффектам. Константа σ зависит только от природы заместителя, а константа р- от характера реакции.
Соединения с различными заместителями, но с одним и тем же реакционным центром образуют реакционную серию.
σ-Константы некоторых заместителей приведены в табл. 15. σ-Константа положительна, если заместитель оттягивает электроны, и отрицательна, если заместитель является донором электронов.
Таблица 15. Значения σ-констант заместителей (по Мак-Даниэлю и Брауну) 
В зависимости от механизма реакции величина ртакже принимает положительные или отрицательные значения. Она положительна, если увеличение скорости реакции вызвано уменьшением электронной плотности в реакционном центре, и отрицательна, если увеличение скорости реакции связано с возрастанием электронной плотности в реакционном центре. Таким образом, по знаку р можно судить о механизме реакции.
Для определения величины р достаточно изучить кинетику превращений ряда соединений, входящих в данную реакционную серию.
Для всех других соединений серии можно рассчитывать константы скорости реакции, используя значения σиз табл. 15.
В настоящее время используется несколько систем реакционных констант а, учитывающих более тонкие взаимные влияния атомов.
Установление возможности применения различных корреляционных уравнений называется корреляционным анализом.
Для о-замещенных соединений простая корреляция обычно не наблюдается, так как о-заместптели влияют друг на друга не только индукционно, но и различными другими способами (стерический эффект, водородная связь, эффект поля и т. д.).
Корреляционный анализ используется в органической химии для установления механизма реакций, строения реагирующих веществ.
Имеющийся в кольце заместитель не только влияет на реакционную способность, но и проявляет ориентирующее действие по отношению к вводимому в кольцо электрофилу.
Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор). Статический фактор отражает распределение электронной плотности в молекуле субстрата. Например, в толуоле электрондонорная группа повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара- положениях.
|
|
|
|
По влиянию статических и динамических факторов на реакционную способность и ориентацию в реакциях электрофильного замещения заместители делятся:
- Заместители I рода – электронодонорные, активирующие группы, орто- и пара ориентанты:
NH 2 , - NHR, - NR 2 , -OH +M>> -I сильно активируют
OCH 3 , -OR, -NHCOR +M> -I умеренно активируют
CH 3 +I слабо активируют
C 6 H 5, - - CH = CH 2 +M> -I слабо активируют
F, -Cl, -Br, -I - I> +M слабо дезактивируют
Если по силе действия +М эффект от группы превосходит –I эффект, то орто- и пара ориентант обогащает бензольное ядро электронной плотностью. В деформированной π-системе эта плотность у атомов углерода повышается не равномерно, и в орто- и пара -положениях возникает частичный отрицательный заряд, облегчая атаку электрофила в этих положениях.
Вместе с тем среди заместителей 1-го рода есть такие в которых - I > +M. Тогда электронная плотность в ядре понижается, и оно становится менее доступным для атаки электрофилов. Однако в орто- и пара-положениях она понижается незначительно. Поэтому нитрование галогенбензола протекает труднее, чем самого бензола.
- Заместители II рода – электроноакцепторные, дезактивирующие группы, мета ориентанты:
С ≡ N, -CHO, -COR, -COOH, -I, -M умеренно дезактивируют
CF 3 , CCl 3 -I сильно дезактивируют
NO 2 -I, -M сильно дезактивируют
Правила ориентации в дизамещенных аренах. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным , если заместители направляют электрофильный реагент в одни и те же положения кольца.

При несогласованной ориентации заместители конкурируют между собой, можно предсказать основное направление реакции, руководствуясь следующими обобщениями:
- Если в кольце есть активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой;

- Атакующий электрфил, как правило, не замещает водород в кольце между двумя заместителями, находящимися в мета –положении относительно друг друга (стерические препятствия);

- Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной.

Реакции моноядерных аренов:
Галогенирование. Бензол в обычных условиях не взаимодействует с хлором или бромом. Реакция протекает только в присутствии катализаторов – кислот Льюиса:

Роль катализатора заключается в поляризации нейтральной молекулы галогена, ведущей к образованию электрофильной частицы. Механизм реакции хлорирования может быть представлен следующим образом:

Алкилбензолы, вследствие электронодонорного эффекта алкильных групп более реакционноспособны в реакциях электрофильного замещения, чем бензол:
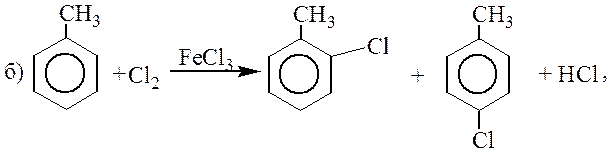
Фторирование протекает слишком бурно, и уже при комнатной температуре происходит деструкция молекул субстрата. Иодирование протекает очень медленно.
Нитрование. Бензол реагирует с концентрированной азотной кислотой очень медленно даже при нагревании. При действии же смесью концентрированных азотной и серной кислот (нитрующая смесь) легко происходит замещение водорода в кольце на нитрогруппу:
Алкилбензолы в реакциях нитрования более реакционноспособны, чем бензол:

Сульфирование. При взаимодействии бензола с серной кислотой или олеумом происходит замещение водорода с образованием бензолсульфоновой кислоты:

Сульфохлорирование . Взаимодействие с хлорсульфоновой кислотой, с образованием бензолсульфохлорида, который растворим в органических растворителях в отличае от бензолсульфоновой кислоты и его легче выделить из реакционной смеси.
Алкилирование. В результате этой реакции в бензольное ядро вводятся алкильные группы с образованием гомологов бензола. В качестве алкилирующих реагентов можно использовать галогеналканы, алкены или спирты.
Алкилирование по Фриделю-Крафтсу (1877) осуществляется в присутствии кислот Льюиса:
Вводимый алкильный заместитель, являясь электронодонором, активрует бензольное кольцо в реакциях электрофильного замещения, что может привести к полиалкилированию. Во избежание этого используется избыток ароматического углеводорода. Арены, содержащие сильные электронноакцепторные заместители, в реакцию алкилирования не вступают. Ароматиские амины, несмотря на наличие электронодонорной аминогруппы, в реакцию алкилирования тоже не вступают, что объясняется потерей активирующего действия аминогруппы за счет взаимодействия ее с катализатором.
Ацилирование. В качестве ацилирующего реагентов чаще всего используют хлорангидриды или ангидриды кислот. Ацилирование по Фриделю-Крафтсу осуществляется в присутствии кислот Льюиса.
Основным фактором, который определяет химические свойства молекулы, является распределение электронной плотности . Характер распределения зависит от взаимного влияния атомов.
Влияние атомов осуществляется через индуктивный эффект (по σ -связи). В молекулах, предоставляющих собой сопряженный системы, имеет место мезомерный эффект : влияние заместителей, передающееся по сопряженной системе π-связей.
Если в кольцо ввести какой-нибудь заместитель, то равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольном кольце определяется природой заместителя.
Заместители делят на 2 группы в зависимости от проявляемого эффекта (мезомерного и индуктивного): электронодонорного и электроноакцепторные.
Электронодонорные заместители проявляют +М и/или + I - эффект и повышают электронную плотность в сопряженной системе. К ним относят: -ОН и - NH 2 группы.
В результате электронная плотность сосредотачивается в орто- и пара- положениях:
Алкильные группы проявляют + I - эффект, под действием которого наблюдается перераспределение π -электронной плотности.
Электроноакцепторные заместители проявляют -М и/или - I - эффект и снижают электронную плотность в сопряженной системе. К таким заместителям относят: -NO 2 , SO 3 H , CHO , - COOH , которые проявляют -М -эффект.
Такие заместители образуют сопряженную систему, но электронная система сдвигается в сторону этих групп. Поэтому электронная плотность уменьшается и в большей степени - в мета-положении:

Галогены проявляют - I -эффект, что также способствуют понижению электронной плотности кольца.
Такие закономерности носят названия правил ориентации в бензольном кольце.
Заместители, которые проявляют + I - эффект или +М - эффект, направляют замещение в орто- и пара-положения бензольного кольца, и называются такие заместители - ориентантами (заместителями) первого рода:
Заместители, обладающие - I и -М -эффектами, направляют замещение в мета-положение бензольного кольца, и называются заместителями второго рода:

Ориентанты 1го рода облегчают вступление второго заместителя, ориентанты 2го - затрудняют его.
В молекуле бензола все шесть атомов углерода равноценны . Вследствие этого не имеет значения, какой атом углерода подвергается замещению. Однако если бензольное кольцо содержит заместитель Х (1-ый заместитель), то положения , оставшиеся свободными, оказываются неравноценными по отношению к заместителю .
!!! Ориентирующее влияние заместителей обусловлено их электронными эффектами (статистический фактор ) и стабильностью промежуточно образующихся аренониевых ионов σ-комплексов (динамический фактор ).
Реакции электрофильного замещения S E характеризуются высокой чувствительностью к влиянию заместителей в субстрате:
Реакции ускоряются при наличии в молекуле субстрата электродонорных заместителей;
замедляются при наличии электроноакцепторных заместителей.
При введении в бензольное кольцо замещающих групп:
Изменяется энергия системы;
Нарушается равномерное распределение электронной плотности;
Появляется чередование заряженности углеродных атомов.
В общем случае электрофильное введение второго заместителя («+») может протекать по трем направлениям:
Рис. 14.15. Схема (статистическая) распределения продуктов при введении второго заместителя (Y) в ароматическое кольцо
Причем статистический фактор должен приводить к образованию 40% продукта орто-замещения , также 40% продукта мета-замещения и 20% продукта пара-замещения. Экспериментальные данные показывают иное соотношение продуктов электрофильного введения второго заместителя (Y ) в ароматическое кольцо:
Таблица 1. Результаты нитрования ряда монозамещенных бензолов нитрующей смесью.
Как видно из таблицы результаты значительно отличаются от статистического прогноза. При этом прослеживается следующая закономерность :
- метильный радикал и хлор ориентируют направление электрофильной атаки в орто- и пара - положения;
- нитро-группа ориентирует, подавляющим образом, в мета -положение.
Кроме того, метильный радикал увеличивает скорость реакции нитрования по сравнению с бензолом, а хлор и нитро-группа понижают .
!!! Закономерности влияния заместителей, определяющие направление реакции замещения в бензольном ядре, называются правилами ориентации .
Исходя из данных таблицы, можно разделить влияние заместителей на две большие категории :
1 . Способность заместителей ориентировать направление электрофильной атаки.
2 . Активация или дезактивация бензольного кольца по отношению к электрофильной атаке.
По способности заместителей ориентировать направление электрофильной атаки различают:
- ориентанты первого (I) рода: орто - / пара -ориентанты;
- ориентанты второго (II) рода: мета -ориентанты.
Ориентанты первого рода дополнительно делятся на активирующие или дезактивирующие бензольное кольцо .
Ориентанты второго рода являются заместителями, дезактивирующими бензольное кольцо .
Действие ориентантов объясняется на основе современной электронной теории: представлении о передаче влияния заместителей по σ - и π- связям индуктивного (и мезомерного эффекта. Ориентант может действовать на кольцо за счёт одного эффекта, либо эти эффекты могут проявляться в различном сочетании (складываться или вычитаться).
К числу активирующих ориентантов первого (I) рода положительными индуктивным (+I ) и мезомерным (+М донорами как для системы σ -связей , так и для цепи сопряжения .
Таковыми являются: -Alk; -О - ; -OH; -OCH 3 ; -NH 2 ; -NHR; -NR 2 (функциональные группы, обладающие неподеленными электронными парами , и имеющие электроотрицательность гетероатома , соизмеримую с электроотрицательностью атома углерода в состоянии sp 2 -гибридизации).
К числу дезактивирующих ориентантов относятся ориентанты 2-го рода , т.е. функциональные группы с отрицательным индуктивным (-I ) и мезомерным (-М ) эффектом. Таковыми являются группы обладающие кратными связями с участием атома углерода или без него: -NO ; - NO 2 ; -SO 3 H ; -COOH ; -CHO ; -COR ; -COOR ; -CºC ; -CºN .
Как видно в состав функциональных групп входят атомы углерода и гетероатомы в состоянии sp 2 -гибридизации и “δ - “ за счет неподелённых электронных пар). Следовательно, их электроотрицательность выше , чем у атомов углерода бензольного кольца и все они дезактивируют бензольное кольцо:

Рис. 14.16. Схема активирующего и дезактивирующего действия ориентантов в ходе реакции электрофильного замещения
К числу дезактивирующих ориентантов первого (I) рода относятся функциональные группы с отрицательным индуктивным (-I ) и положительным мезомерным (+М ) эффектом т.е. функциональные группы являющиеся акцепторами по системе σ-связей , и донорами по цепи сопряжения . Таковыми являются хлор (Cl ), бром (Br ) и ацетамидная группа (-NHC(O)CH 3 ).

Рис. 14.17. Схема активирующего и дезактивирующего действия ориентантов в ходе реакции электрофильного замещения
В таблице 14.2 приведены заместители, и ориентирующее действие и электронные эффекты.
Таблица 14.2. Заместители, их ориентирующее действие и электронные эффекты.

Механизм действия ориентантов:

Рис. 14.18. Схема перераспределения электронной плотности в ароматическом кольце
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только σ-связи, взаимное влияние атомов осуществляется через индуктивный эффект.
В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
Влияние заместителей, передающееся по сопряженной системе π -связей, называется мезомерным (М) эффектом.
В молекуле бензола p -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
1. Электронодонорные заместители проявляют +М- и +I- эффект и повышают электронную плотность в сопряженной системе.
К ним относятся гидроксильная группа -ОН и аминогруппа -NН 2 . Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара -положениях:
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
2. Электроноакцепторные заместители проявляют -М- эффект и снижают электронную плотность в сопряженной системе.
К ним относятся нитрогрупла -NO 2 , сульфогруппа -SO 3 Н, альдегидная -СНО и карбоксильная -СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета- положениях:
Полностью галогенизированные алкильные радикалы (например, -ССl 3) проявляют -I- эффект и также способствуют понижению электронной плотности кольца.
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
I . Заместители, обладающие +I - эффектом или +М - эффектом, способствуют электрофильному замещению в орто- и пара- положениях бензольного кольца и называются заместителями (ориентантами) первого рода :
II . Заместители, обладающие -I- эффектом или -М- эффектом, направляют электрофильное замещение в мета- положения бензольного кольца и называются заместителями (ориентантами) второго рода:
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто -положения:
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета- положение:
Помимо ориентирующего действия заместители оказывают влияние и на реакционную способность бензольного кольца : ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя ; ориентанты 2-го рода (и галогены) затрудняют его .
 staterenta.ru Виды макияжа. Материалы. Лицо. Форма бровей.
staterenta.ru Виды макияжа. Материалы. Лицо. Форма бровей.





